|
|
|
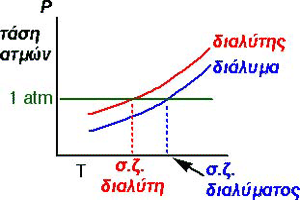
| Tάση
ατμών
ενός υγρού σε μια ορισμένη θερμοκρασία, ονομάζεται η πίεση που ασκούν
οι ατμοί του υγρού όταν το υγρό βρίσκεται σε ισορροπία με τους ατμούς
του.
Αν διαλύσουμε μια μη πτητική ουσία σ΄ ένα υγρό διαλύτη π.χ. ένα στερεό, παρατηρείται ελάττωση της τάσης των ατμών του διαλύτη. Το υγρό, δηλαδή,
εξατμίζεται δυσκολότερα. |
 |
|
|
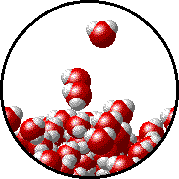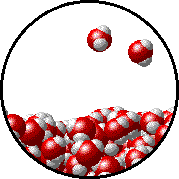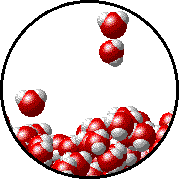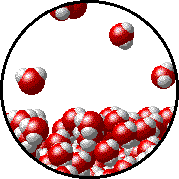
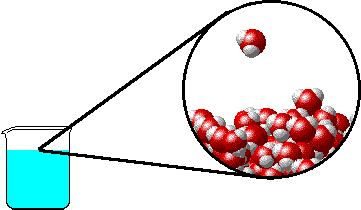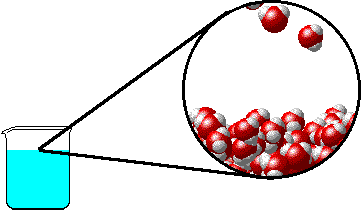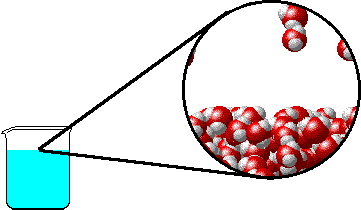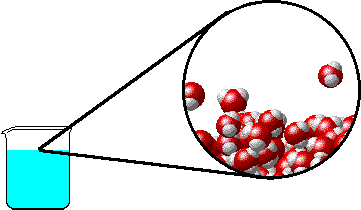
Το φαινόμενο εξηγείται ως εξής: Στην επιφάνεια του καθαρού διαλύτη υπάρχουν αποκλειστικά μόρια διαλύτη. Ορισμένα απ΄ αυτά υπερνικούν τις διαμοριακές δυνάμεις και εξατμίζονται. Η παρουσία του μη πτητικού διαλυμένου σώματος ελαττώνει τον αριθμό των μορίων του διαλύτη στην επιφάνεια του υγρού, επομένως η εξάτμιση περιορίζεται και η τάση ατμών ελαττώνεται.
|
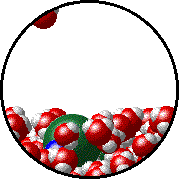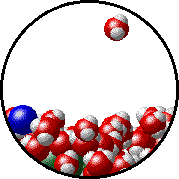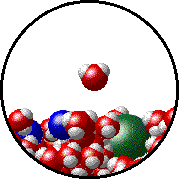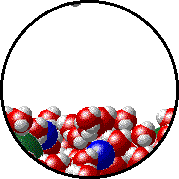 |
Προφανώς όσο μεγαλύτερη είναι η ποσότητα του διαλυμένου σώματος, τόσο μεγαλύτερη μείωση της τάσης ατμών παρατηρείται. |
|
Η μείωση της τάσης των ατμών ενός υγρού κατά τη διάλυση σε αυτό μιας μη πτητικής ουσίας, μελετήθηκε πειραματικά το 1886 από το Γάλλο χημικό Francois Raoult. Τα αποτελέσματα της μελέτης του αυτής διατυπώθηκαν με τη μορφή ενός νόμου, που σήμερα είναι γνωστός ως νόμος Raoult
Μαθηματικά εκφρασμένος ο νόμος αυτός είναι :
Άλλη έκφραση του νόμου του Raoult είναι η εξής:
|
|
|
Ο νόμος του Raoult είναι ακριβής σε ιδανικά διαλύματα. Ιδανικό θεωρείται το διάλυμα του οποίου οι διαμοριακοί δεσμοί μεταξύ διαλύτη -διαλυμένου σώματος (π.χ. Α-Β) είναι της ίδιας περίπου ισχύος με αυτούς που εμφανίζονται μεταξύ των μορίων διαλύτη - διαλύτη (π.χ. Α-Α) και διαλυμένου σώματος - διαλυμένου σώματος (π.χ. Β-Β). Πιθανόν κανένα διάλυμα δεν καλύπτει πλήρως τις προϋποθέσεις αυτές. Πολλά όμως διαλύματα θεωρούνται ότι προσεγγίζουν ικανοποιητικά την εικόνα αυτή, ώστε να θεωρούνται ιδανικά. Παράδειγμα φέρνουμε το μίγμα υδρογονανθράκων στη βενζίνη ή το μίγμα βενζολίου - τολουολίου. Γενικώς ο νόμος του Raoult εφαρμόζεται ικανοποιητικά σε αραιά διαλύματα μοριακών ενώσεων σε υγρά, καθώς και σε διαλύματα δύο χημικά παρομοίων υγρών. Πρέπει πάντως να τονισθεί ότι ο νόμος αυτός με κατάλληλη τροποποίηση μπορεί να εφαρμοστεί και σε αραιά διαλύματα ιοντικών ενώσεων. Ο νόμος του Raoult στη μορφή που δίνεται, ισχύει με την προϋπόθεση ότι: · η διαλυμένη ουσία είναι μη πτητική · το διάλυμα είναι αραιό · το διάλυμα είναι μοριακό, δηλαδή η διαλυμένη ουσία είναι σε μορφή μορίων Παρατηρήσεις 1. Ο νόμος Raoult ισχύει και όταν έχουμε περισσότερες από μία μη πτητικές διαλυμένες ουσίες. Τότε, n ουσίας = n1+ n2 + n3 2. Ο νόμος του Raoult μπορεί να εφαρμοστεί και σε μίγματα πτητικών υγρών. Στην περίπτωση αυτή το κάθε υγρό δρα ως διαλύτης, που διαλύει το άλλο. Αυτό σημαίνει ότι η τάση των ατμών του καθενός υγρού μειώνεται, σύμφωνα με το νόμο του Raoult. Έτσι, στην περίπτωση διαλύματος πτητικών υγρών Α και Β, ισχύει: PA = PAo · ΧΑ και PΒ = PΒo · ΧΒ Όπου, PAo και PΒo : οι τάσεις ατμών των καθαρών υγρών Α και Β PA και PΒ : οι τάσεις ατμών των υγρών Α και Β, όταν τα υγρά αυτά είναι αναμιγμένα μεταξύ τους και ΧΑ, ΧΒ : τα γραμμομοριακά κλάσματα των Α και Β στο διάλυμα. |
|