 |
|
|
 |
Η
μετάβαση μιας ουσίας από την υγρή στην αέρια φάση είναι στενά συνδεδεμένη
με την τάση ατμών της συγκεκριμένης ουσίας.
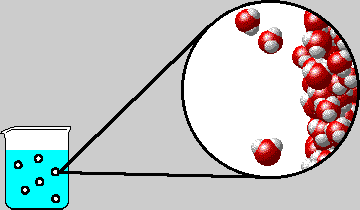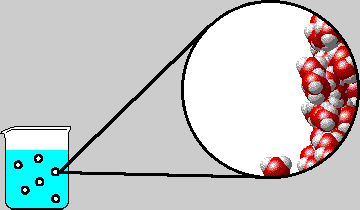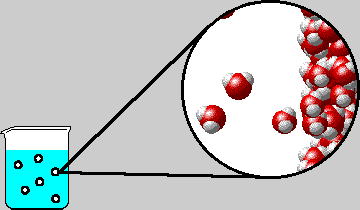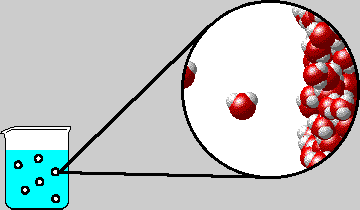
Ως σημείο βρασμού (ή σημείο ζέσεως) ορίζεται η θερμοκρασία εκείνη στην οποία η τάση ατμών του υγρού εξισώνεται με την εξωτερική πίεση. Στην περίπτωση του καθαρού νερού και όταν η εξωτερική πίεση είναι 1 atm αυτό συμβαίνει στους 100 °C. (κανονικό σημείο βρασμού του νερού).
|
| Σ΄ένα
υδατικό διάλυμα η τάση ατμών του διαλύματος είναι μικρότερη από εκείνη
του καθαρού νερού, με αποτέλεσμα το
σημείο ζέσεως να ανυψώνεται
Μάλιστα, όσο μεγαλύτερη είναι η συγκέντρωση του διαλύματος, τόσο μικρότερη είναι η τάση ατμών του διαλύματος, άρα και τόσο μεγαλύτερη είναι η ανύψωση του σημείου ζέσεως.
|
|
 |
|
| Ζεσεοσκοπία
ονομάζεται η μέθοδος προσδιορισμού της σχετικής μοριακής μάζας με
βάση τη μέτρηση πειραματικά του ΔΤb, εφαρμόζοντας τον παρακάτω νόμο:
Η ανύψωση του σημείου ζέσεως εξαρτάται από τη συγκέντρωση του διαλύματος και μάλιστα ισχύει:
ΔΤb=Kb
molality όπου
Όταν η μοριακότητα κατά βάρος του διαλύματος είναι 1 m, τότε η τιμή της ΔΤb είναι αριθμητικά ίση με την Κb.
|
|