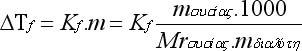|
Ταπείνωση
του σημείου πήξεως

Κανονικό σημείο πήξεωςμιας ουσίας είναι η θερμοκρασία στην οποία η ουσία μεταβαίνει από την υγρή στην στερεή κατάσταση, όταν η πίεση ισούται με 1atm. Το κανονικό σημείο πήξεως του καθαρού νερού είναι 0 0C Το σημείο πήξεως ενός διαλύματος είναι χαμηλότερο από εκείνο του καθαρού διαλύτη. Έτσι, π.χ.
το θαλασσινό νερό, που είναι πλούσιο σε άλατα, δεν πήζει τόσο εύκολα
όσο το νερό των λιμνών και των ποταμών |
|
Η ταπείνωση του σημείου πήξεως είναι και αυτή μία προσθετική ιδιότητα η οποία εξαρτάται από τη συγκέντρωση του διαλύματος.
Δηλαδή: ΔΤf = Kf molality όπου ΔΤf: η μεταβολή του σ.π., Κf : η κρυοσκοπική σταθερά του διαλύτη, molality : η μοριακή κατά βάρος συγκέντρωση του διαλ/τος.
Όταν η μοριακότητα κατά βάρος του διαλύματος είναι 1 m, τότε η τιμή της ΔΤf είναι αριθμητικά ίση με την Κf. Η εξίσωση της ταπείνωσης του σ.π. ισχύει με την προϋπόθεση ότι: i)το διάλυμα είναι αραιό, ii)το διάλυμα είναι μοριακό, δηλαδή η διαλυμένη ουσία είναι υπό μορφή μορίων. Γενικά αναφέρουμε ότι οι μεταβολές στο σ.π., που προκαλούνται κατά τη διάλυση μιας ουσίας σ' ένα διαλύτη, είναι πιο σημαντικές από τις αντίστοιχες του σ.β. Για το λόγο αυτό, και επειδή το σ.π. μετράται πειραματικά με μεγαλύτερη ακρίβεια από το σ.β., η κρυοσκοπία βρίσκει πολλές εφαρμoγές.
|
|
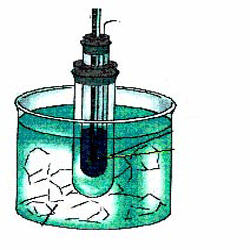
Κρυοσκοπία ονομάζεται η μέθοδος προσδιορισμού της σχετικής μοριακής μάζας της διαλυμένης ουσίας με βάση τη μέτρηση πειραματικά της μεταβολής που παρουσιάζει το σημείο πήξεως, ΔΤf, εφαρμόζοντας τον παρακάτω νόμο:
όπου
Συσκευή κρυοσκοπίας προσδιορισμού ταπείνωσης σημείου πήξεως.
|
|
Μιλώντας γενικά πρέπει να αναφέρει κανείς, ότι η διάλυση 1 mol μιας ουσίας δε δημιουργεί πάντα και 1 mol σωματιδίων στο διάλυμα. Το διαλυμένο σώμα μπορεί να διίσταται (ή ιοντίζεται) πλήρως ή μερικώς σχηματίζοντας έτσι μεγαλύτερο αριθμό σωματιδίων. Στον αντίποδα αυτού είναι δυνατό τα μόρια του διαλυμένου σώματος να συμπυκνώνονται ή να πολυμερίζονται ή να συσσωματώνονται πλήρως ή μερικώς προς μεγαλύτερα συγκροτήματα, οπότε βέβαια ο αριθμός των ανεξαρτήτων σωματιδίων μικραίνει. Με βάση τις αντιλήψεις του vant Hoff oι προσθετικές ιδιότητες των ηλεκτρολυτικών διαλυμάτων μπορούν να εκφραστούν με βάση τις σχέσεις:
ΔΤf =i Κf m
ΔΤb = i Kb m
Π = i CRT
Για παράδειγμα i =2 στην περίπτωση του NaCl, καθώς από κάθε mol NaCl προκύπτουν λόγω διάστασης δύο mol ιόντων.
Τέτοιες πληροφορίες για διάσταση ή πολυμερισμό συχνά προκύπτουν από τη μελέτη των προσθετικών διαλυμάτων του διαλύματος. Εφαρμογές της ταπείνωσης του σ.π. αποτελεί η προσθήκη αντιπηκτικών υγρών στο νερό των ψυγείων των αυτοκινήτων. Άλλη εφαρμογή είναι η χρησιμοποίηση αλάτων όπως NaCl καιCaCl2 για το λιώσιμο των πάγων στους χιονισμένους δρόμους. .
|